Окисление
Содержание:
- Введение
- Охрана атмосферы
- Реакция над металлами
- Особенности реакций
- Примеры
- Горение
- Образование Ацетил-КоА и АТФ на примере окисления пальмитоил-CoA
- Окисление органических веществ в клетке организмов растений, животных и человека
- Особенности окисления в пероксисомах
- Химия — это просто
- 1.1.3 Окислительно-восстановительные свойства элементов в зависимости от строения их атомов
- Важнейшие окислители и восстановители
- Биохимия окисления жирных кислот в митохондриях
- Транспортировка в митохондрии
- Электролиз , как окислительно-восстановительный процесс
- Классификация
- Что мы узнали?
- Тест по теме
- Основные сведения о жирных кислотах
- Реакция над водой
Введение
С основной и изначальной точки зрения, окисление – это процесс химического характера, что сопровождается увеличением степени атомарного окисления вещества, которое ему подвергается. Это явление происходит, благодаря передаче электронов от одного атома (восстановителя и донора) до второго (акцептора и окислителя).
Данная терминологическая единица была введена в оборот химии в начале XIX века, а сделал это академик В.М. Севергин для создания обозначения, указывающего на взаимодействие веществ с кислородом из атмосферного воздуха.
В некоторых случаях окисление молекулы сопровождается созданием нестабильности в структуре вещества и приводит к его распаду на молекулы, обладающие большей стабильностью и маленькими размерами. Дело в том, что данный процесс повторяться может на нескольких разных уровнях измельчения. То есть, образованная более маленькая частица может также обладать более высокой степенью окисления, чем атомарные частички, что были исходными в том же веществе, но крупнее и стабильнее.
В химии есть понятие низшей и высшей степени окисления. Это позволяет классифицировать атомы по возможности их проявлять данное свойство. Высшая окислительная степень соответствует номеру группы, в котором находится элемент. Низшая степень, как правило, определяется по соответствию четного и нечетного числа: высшая 8 = низшая 2, высшая 7 = низшая 1.
Охрана атмосферы
В результате деятельности человека происходит загрязнение атмосферы самыми различными веществами, многие из которых ядовиты для человека, животных и растений. Изменение состава атмосферы приводит к ослаблению здоровья населения, снижению продолжительности жизни, распространению болезней. Это особенно заметно в больших городах, где атмосфера загрязняется газовыми выбросами промышленных предприятий и автомобильного транспорта.
В состав почти всех известных традиционных видов топлива входят вещества, при сгорании которых образуются не только СО2 и Н2О. При неполном сгорании топлива может образовываться весьма ядовитый угарный газ (СО). Также очень неблагоприятны для человека продукты сгорания соединений, содержащих атомы серы и азота, которыми являются оксиды серы (SO2) и азота (NO, NO2).
Для улучшения качества бензина в него добавляют соединения свинца. При сгорании такого бензина в окружающую среду выбрасывается большое количество ядовитых для человека веществ, содержащих свинец.
На сжигание различных видов топлива потребляется огромное количество кислорода. Так, в течение 1 ч. полета реактивный самолет (рис. 91) потребляет количество кислорода, вырабатываемое лесом площадью 1 га. за месяц.
Смог (рис. 92) — это туман, смешанный с пылью и сажей и содержащий продукты взаимодействия оксидов серы и азота с водой.
Кислотные дожди. Дождевая вода более кислая, чем обычная, так как в ней содержатся вещества, называемые кислотами. Они образуются при взаимодействии оксидов серы и азота с парами воды.
Парниковый эффект (рис. 93) возникает в результате повышения температуры воздуха за счет накопления в атмосфере некоторых газов, называемых парниковыми. Основным парниковым газом является углекислый газ. В результате парникового эффекта повышается температура воздуха в нижних слоях атмосферы, происходит изменение климата, возможны таяния ледников, наводнения.
Поскольку атмосфера у всех народов Земли общая, разные государства предпринимают совместные меры по ее защите от вредных выбросов. Для этого на заводах устанавливаются очистительные установки, совершенствуются системы очистки выхлопных газов автотранспорта, разрабатываются новые экологически чистые производства и виды транспорта.
Уменьшить влияние химических веществ на природу, здоровье людей возможно, только сделав самые тщательные исследования источников и состава ядовитых соединений. Химия как наука позволяет человеку найти пути решения указанных выше проблем охраны атмосферы.
Краткие выводы урока:
- Окисление — химическая реакция, в результате которой атомы кислорода присоединяются к атомам других элементов.
- Топливо — это вещество, которое горит с выделением тепловой энергии.
- Основными видами топлива являются каменные и бурые угли, торф, древесина, нефть и природный газ.
- Сжигание различных видов топлива приводит к таким неблагоприятным последствиям, как смог, кислотные дожди и парниковый эффект.
Надеюсь урок 20 «Окислительные процессы» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Реакция над металлами
Окисление металла – это реакция, в ходе которой посредством взаимодействия элемента из группы металлов и O2, происходит образование окислов (оксидов).
В широком значении – реакция, в которой атом теряет электрон и создает разнообразные соединения, например, вещества хлоридов, сульфидов и т. п. В природном состоянии чаще всего металлы находиться могут лишь в полностью окисленном состоянии (в виде руды). Именно по этой причине, процесс окисления представлен в виде реакции восстановления различных компонентов соединения. Практически применяемые вещества металлов и их сплавов при взаимодействии с окружающей средой постепенно окисляются – подвергаются коррозии. Процессы окисления металлов происходят, благодаря термодинамическим и кинетическим факторам.
Особенности реакций
Окисление ненасыщенных жирных кислот имеет некоторые особенности. Так, сложность окисления цепей с двойными связями заключается в том, что последние не могут подвергаться воздействию еноил-CoA-гидратазы из-за того, что находятся в цис-положении. Эта проблема устраняется еноил-CoA-изомеразой, благодаря которой связь приобретает транс-конфигурацию. В результате молекула становится полностью идентичной продукту первой стадии бета-окисления и может подвергаться гидратации. Участки, содержащие только одинарные связи, окисляются так же, как насыщенные кислоты.
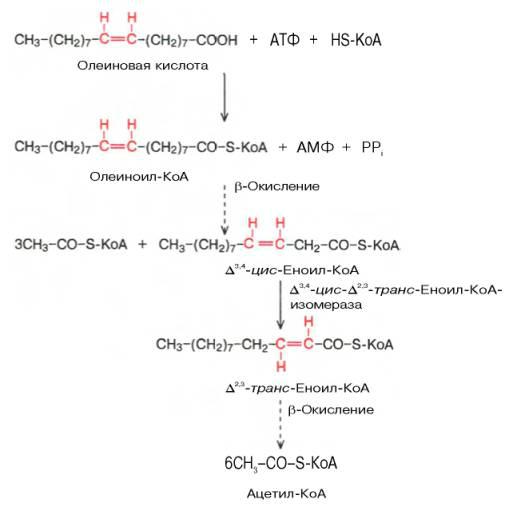
Иногда для продолжения процесса недостаточно еноил-CoA-изомеразы. Это касается цепей, в которых присутствует конфигурация цис9-цис12 (двойные связи при 9-м и 12-м атомах углерода). Здесь помехой является не только конфигурация, но и положение двойных связей в цепи. Последнее исправляется ферментом 2,4-диеноил-CoA-редуктазой.
Примеры
Окислительно-восстановительная реакция между водородом и фтором
-
- H2+F2→2H+1F−1{\displaystyle {\mathsf {{\stackrel {0}{\mbox{H}}}_{2}+{\stackrel {0}{\mbox{F}}}_{2}\rightarrow 2{\stackrel {+1}{\mbox{H}}}{\stackrel {-1}{\mbox{F}}}}}}
Разделяется на две полу-реакции:
1) Окисление:
-
- H2−2e−→2H+{\displaystyle {\mathsf {{\mbox{H}}_{2}^{0}-2{\mbox{e}}^{-}\rightarrow 2{\mbox{H}}^{+}}}}
2) Восстановление:
-
- F2+2e−→2F−{\displaystyle {\mathsf {{\mbox{F}}_{2}^{0}+2{\mbox{e}}^{-}\rightarrow 2{\mbox{F}}^{-}}}}
-
- H2−2e−→2H+{\displaystyle {\mathsf {{\mbox{H}}_{2}^{0}-2{\mbox{e}}^{-}\rightarrow 2{\mbox{H}}^{+}}}}
- S2−−2e−→S↓{\displaystyle {\mathsf {{\mbox{S}}^{2-}-2{\mbox{e}}^{-}\rightarrow {\mbox{S}}^{0}\downarrow }}}
- Al−3e−→Al3+{\displaystyle {\mathsf {{\mbox{Al}}^{0}-3{\mbox{e}}^{-}\rightarrow {\mbox{Al}}^{3+}}}}
- Fe2+−e−→Fe3+{\displaystyle {\mathsf {{\mbox{Fe}}^{2+}-{\mbox{e}}^{-}\rightarrow {\mbox{Fe}}^{3+}}}}
- 2Hal−−2e−→Hal2{\displaystyle {\mathsf {2{\mbox{Hal}}^{-}-2{\mbox{e}}^{-}\rightarrow {\mbox{Hal}}_{2}^{0}}}}
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
-
- O2+4e−→2O2−{\displaystyle {\mathsf {{\mbox{O}}_{2}^{0}+4{\mbox{e}}^{-}\rightarrow 2{\mbox{O}}^{2-}}}}
- Mn7++5e−→Mn2+{\displaystyle {\mathsf {{\mbox{Mn}}^{7+}+5{\mbox{e}}^{-}\rightarrow {\mbox{Mn}}^{2+}}}}
- Mn4++2e−→Mn2+{\displaystyle {\mathsf {{\mbox{Mn}}^{4+}+2{\mbox{e}}^{-}\rightarrow {\mbox{Mn}}^{2+}}}}
- Cr6++6e−→Cr{\displaystyle {\mathsf {{\mbox{Cr}}^{6+}+6{\mbox{e}}^{-}\rightarrow {\mbox{Cr}}^{0}}}}
Атомы или ионы, которые в данной реакции присоединяют электроны, являются окислителями, а атомы или ионы, которые отдают электроны — восстановителями.
Для нахождения пропорции веществ, вступающих в химическую реакцию, часто требуется уравнять ОВР. Уравнивание ОВР сводится к нахождению стехиометрических коэффициентов (то есть, количества молей каждого соединения). Стехиометрические коэффициенты могут принимать только значения целых величин от 1 и выше, дробные стехиометрические коэффициенты допускаются лишь в некоторых случаях записи термохимических уравнениях из курса физической химии. Различают два метода уравнивания ОВР: метод полуреакций и метод электронного баланса. Метод электронного баланса более прост и используется в случае протекания реакции в газообразной среде (например, процессы горения или термического разложения соединений). Метод полуреакций более сложен и используется в случае протекания реакции в жидкой среде. Метод полуреакций оперирует не свободными атомами и одноатомными ионами, а реально существующими в растворе частицами, образовавшимися в результате процессов растворения и/или диссоциации реагирующих веществ
Оба метода занимают важное место в базовом курсе общей и неорганической химии, изучаемом студентами различных учебных заведений.
Горение
Горение – это процесс окисления. В атмосферном воздухе (а также в среде чистого кислорода) могут поддаваться окислению в форме горения. Примером могут служить разнообразные вещества: простейшие элементы веществ металлов и неметаллов, неорганические и органические соединения. Однако самым практически значимым является горючее вещество (топливо), среди которых выделяют природные запасы нефти, газов, угля, торфа и т. д. Чаще всего они образуют из сложной смеси углеводородов с малой долей кислорода, серы, азотосодержащих соединений органического типа, а также включениями следового количества прочих элементов.

Образование Ацетил-КоА и АТФ на примере окисления пальмитоил-CoA
В конце каждого цикла в единственном количестве образуются молекулы ацил-CoA, НАДН и ФАДН2, а цепь ацил-CoA-тиоэфира становится короче на два атома. Передавая электроны в электротранспортную цепь, ФАДН2 дает полторы молекулы АТФ, а НАДН — две. В результате из одного цикла получается 4 молекулы АТФ, не считая энерговыход ацетил-CoA.

В цепочку пальмитиновой кислоты входит 16 углеродных атомов. Это означает, что на стадии окисления должно осуществиться 7 циклов с образованием восьми ацетил-CoA, а энерговыход от НАДН и ФАДН2 в таком случае составит 28 молекул АТФ (4×7). Окисление ацетил-CoA тоже идет на образование энергии, которая запасается в результате поступления в электротранспортную цепь продуктов цикла Кребса.
Окисление органических веществ в клетке организмов растений, животных и человека
Это наиболее важный вопрос не только для тех людей, которые интересуются химией. Подобного рода знания должен иметь каждый, чтобы сформировать верное представление о разных процессах в природе, о ценности каких-либо веществ в мире и даже о самом себе – человеке.
Из курсов школьной биологии вы, наверное, уже в курсе, что окисление органики играет не последнюю биологическую роль в организме человека. В результате окислительно-восстановительных реакций происходит расщепление БЖУ (белков, жиров, углеводов): в клетках выделяется теплота, АТФ и другие носители энергии, и наше тело всегда обеспечено достаточным запасом для выполнения действий и нормального функционирования систем органов.
Протекание данного процесса способствует поддержанию постоянной температуры тела в организме не только человека, но и любого другого теплокровного животного, а также помогает регулировать постоянство внутренней среды (это называется гомеостаз), обмен веществ, обеспечивает качественную работу органоидов клетки, органов, а также выполняет ещё множество необходимых функций.
При фотосинтезе растениями поглощается вредный углекислый газ и образуется кислород, необходимый для дыхания.
Биологическое окисление органических веществ может протекать исключительно с использованием различных переносчиков электронов и ферментов (без них данный процесс длился бы невероятно долго).
Особенности окисления в пероксисомах
В пероксисомах окисление жирных кислот происходит по бета-механизму, который подобен, но не идентичен митохондриальному. Он также состоит из 4-х стадий, завершающихся образованием продукта в виде ацетил-CoA, но при этом имеет несколько ключевых отличий. Так, водород, отщепившийся на стадии дегидрирования, не восстанавливает ФАД, а переходит на кислород с образованием перикиси водорода. Последний сразу подвергается расщеплению под действием каталазы. В результате энергия, которая могла быть использована для синтеза АТФ в дыхательной цепи, рассеивается в виде тепла.
Второе важное различие заключается в том, что некоторые ферменты пероксисом специфичны к определенным малораспространенным жирным кислотам и отсутствуют в митохондриальном матриксе. Особенность пероксисом клеток печени заключается в том, что там отсутствует ферментный аппарат цикла Кребса
Поэтому в результате бета-окисления образуются короткоцепочечные продукты, которые для окисления транспортируются в митохондрии
Особенность пероксисом клеток печени заключается в том, что там отсутствует ферментный аппарат цикла Кребса. Поэтому в результате бета-окисления образуются короткоцепочечные продукты, которые для окисления транспортируются в митохондрии.
Химия — это просто
- Популярно о химии
-
· Что такое химия
· Периодическая таблица - ОБЩАЯ ХИМИЯ
- Вещества и смеси
- Атомы и молекулы
- Строение веществ
- Взаимодействие веществ
-
· Виды химических реакций
· Уравнения химических реакций
· Классификации химических реакций
· Баланс химических реакций
· Химическое равновесие
· Скорость химических реакций
· Окислительно-восстановительные реакции
· Составление уравнений ОВР
· Тепловой эффект реакции
· Закон Гесса
· Электрохимические элементы
· Кислоты и основания
· Сильные кислоты и основания
· Слабые кислоты и основания
· Кислотно-основные реакции
· Индикаторы
· Водородный показатель pH - НЕОРГАНИЧЕСКАЯ ХИМИЯ
- ОРГАНИЧЕСКАЯ ХИМИЯ
1.1.3 Окислительно-восстановительные свойства элементов в зависимости от строения их атомов
Способность
химических элементов присоединять или
отдавать электроны связана со строением
атомов и их положением в периодической
системе элементов Д. И. Менделеева.
Атомы
металлов в химических реакциях способны
лишь отдавать электроны и быть
восстановителями.
К
металлическим элементам относятся:
элементы 1-2 групп; элементы 3-12 групп, а
также лантаниды и актиниды; элементы
13 группы, кроме бора; элементы 14 группы,
кроме углерода и кремния; элементы 15
группы, кроме азота, фосфора и мышьяка.
Атомы металлических элементов содержат
на внешнем уровне один, два, три электрона.
Наиболее
активными восстановителями являются
щелочные и щелочноземельные металлы,
среди которых самый активный – франций.
Мерой восстановительной активности
металлов является энергия ионизации.
Для
неметаллов: F,Cl,Br,I,At,O,S,Se,Te,N,P,As,C,Si,B,Hболее
характерно присоединение электронов.
Атомы неметаллов, за исключением водорода
и бора, на внешнем энергетическом уровне
имеют четыре, пять, шесть, семь электронов.
Наиболее
активно присоединяют электроны атомы
фтора, который, имея самую высокую
электроотрицательность, является
сильным окислителем. За ним по окислительной
способности идёт кислород, атомы которого
могут отдавать электроны только атомам
фтора. Другие неметаллы могут не только
принимать, но и отдавать электроны, а
значит, проявляют не только окислительные,
но и восстановительные свойства, которые
выражены много слабее. Мерой окислительной
способности атома является величина,
называемая сродством к электрону.
Относительно
окислительно-восстановительных свойств
ионов можно сказать следующее. Катионы
щелочных и щелочноземельных металлов
почти не проявляют окислительных
свойств. Напротив, катионы малоактивных
металлов в высшей степени окисления
являются окислителями, например Fe3+.
Катионы металлов в промежуточной или
минимальной степени окисления
преимущественно проявляют восстановительные
свойства, напримерFe2+.
Отрицательно
заряжённые ионы неметаллов (Cl-,S2-,N3-и другие) проявляют только восстановительные
свойства.
Например:
S2— 2ē →S
В
пределах каждого периода с возрастанием
порядкового номера элементов их
восстановительная способность понижается,
а окислительная — возрастает. Так, во
втором периоде литий — только восстановитель,
а фтор – только окислитель. Это результат
возрастания заряда ядра атомов, уменьшения
радиуса атомов и постепенного заполнения
электронами внешнего энергетического
уровня (у атома лития один электрон, у
атома фтора их семь). Энергия ионизации
при этом возрастает, и также возрастает
сродство к электрону.
В
пределах каждой группы s-
иp-элементов с возрастанием
порядкового номера элементов
восстановительная способность их атомов
возрастает, а окислительная способность
убывает. Так, в 16 группе кислород –
сильный окислитель, а теллур – очень
слабый окислитель и в некоторых реакциях
проявляет даже свойства восстановителя.
Эти закономерности обусловлены
увеличением радиуса атомов элементов,
в связи с чем уменьшается энергия
ионизации и сродство к электрону.
Важнейшие окислители и восстановители
Все химические элементы можно разделить на два больших класса — элементы с постоянными степенями окисления (такие элементы, как правило, не меняют свою степень окисления в сложных веществах), и элементы с переменной степенью окисления (такие элементы легко отдают или принимают электроны). По этой причине свойства сложных веществ обусловлены наличием в их составе элементов с переменной степенью окисления.
В свою очередь, элементы с переменной степенью окисления подразделяются на три категории:
- элементы с высшей степенью окисления — такие элементы могут только понижать свою степень окисления (участвовать в процессе восстановления), следовательно, вещество, в состав которого входят такие элементы, может выступать только в роли окислителя (присоединять электроны), например, перманганат калия (марганцовка) может быть только окислителем, поскольку марганец в KMnO4 имеет высшую степень окисления +7.
- элементы с низшей степенью окисления — такие элементы могут только повышать свою степень окисления (участвовать в процесс окисления), следовательно, вещество, в состав которого входят такие элементы, может выступать только в роли восстановителя (отдавать электроны), например, аммиак является восстановителем, поскольку, азот, входящий в состав NH3, имеет низшую степень окисления -3.
- элементы с промежуточной степенью окисления — такие элементы могут, как отдавать электроны, так и принимать их (все зависит от «партнера» по реакции), следовательно, вещество, в состав которого входят такие элементы, может быть, как окислителем, так и восстановителем, например, сера, входящая в состав сульфита натрия Na2SO3, имеет промежуточную степень окисления +4, по этой причине сульфит натрия в реакции с перманганатом калия окисляется до сульфата натрия (является восстановителем), а в реакции с сероводородом сульфит натрия восстанавливается до свободной серы (является окислителем).
Активные окислители:
- простые вещества:
- кислород (O2);
- фтор (F2);
- сложные вещества:
- перманганат калия (KMnO4);
- хроматы и дихроматы (K2Cr2O7);
- азотная кислота и ее соли (HNO3);
- хлорная кислота и ее соли (HClO4);
- концентрированная серная кислота (H2SO4);
- оксид свинца (PbO2).
Активные восстановители:
- все простые вещества-металлы, наиболее активные:
- щелочные металлы;
- щелочноземельные металлы;
- магний (Mg);
- алюминий (Al);
- цинк (Zn).
- сложные вещества:
- метан (CH4);
- аммиак(NH3);
- силан(SiH4);
- фосфин(PH3);
- нитриды и фосфиды металлов (Na3N, Ca3P2)
- сероводород (H2S)
- галогеноводороды (HI, HBr, HCl)
- сульфиды и галогениды металлов
- гидриды металлов (NaH, CaH2)
промежуточной степенью окисления
- чаще являются окислителями:
- галогены (Cl2; Br2);
- хлорноватистая кислота (HClO) и ее соли (гипохлораты, хлораты);
- оксид марганца (IV) MnO2;
- соли трехвалентного железа (FeCl3)
- чаще являются восстановителями:
- водород (H2);
- углерод (C);
- оксид углерода (II) CO;
- сульфиты металлов (Na2SO3);
- соли двухвалентного железа (FeSO4)
Разновидности окислительно-восстановительных реакций:
-
межмолекулярные — окислитель и восстановитель являются разными веществами:
N2+H2→N-3H3+1
-
внутримолекулярные — окислитель и восстановитель входят в состав одного вещества:
N-3H4N+3O2→N2+H2O
-
реакции диспропорционирования — окисляется и восстанавливается один и тот же элемент, находящийся в промежуточной степени окисления:
N+4O2+H2O→HN+5O3+3+HNO2
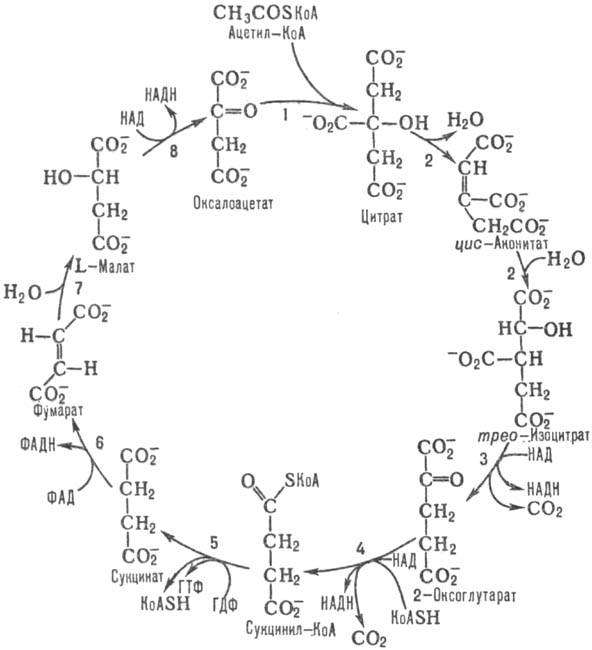
Биохимия окисления жирных кислот в митохондриях
Для удобства процесс митохондриального катаболизма условно подразделяется на 3 этапа:
- активация и транспортировка в митохондрии;
- окисление;
- окисление образовавшегося ацетил-коэнзима А через цикл Кребса и электротранспортную цепь.
Активация представляет собой подготовительный процесс, который переводит жирные кислоты в форму, доступную для биохимических превращений, так как сами по себе эти молекулы инертны. Кроме того, без активации они не могут проникнуть в мембраны митохондрий. Эта стадия протекает у внешней мембраны митохондрий.
Собственно, окисление — ключевой этап процесса. Оно включает четыре стадии, по окончании которых жирная кислота превращается в молекулы Ацетил-КоА. Тот же продукт образуется и при утилизации углеводов, так что дальнейшие этапы аналогичны последним стадиям аэробного гликолиза. Образование АТФ происходит в цепи переноса электронов, где энергия электрохимического потенциала используется для образования макроэргической связи.
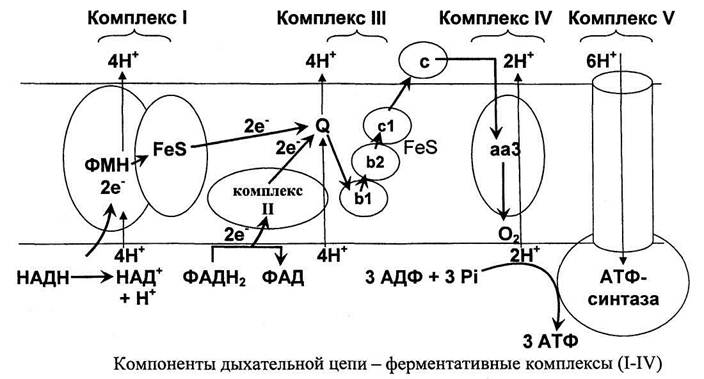
В процессе окисления жирной кислоты кроме Ацетил-КоА образуются также молекулы NADH и FADH2, которые тоже поступают в дыхательную цепь в качестве доноров электронов. В результате суммарный энергетический выход катаболизма липидов достаточно высок. Так, к примеру, окисление пальмитиновой кислоты по β-механизму дает 106 молекул АТФ.
Транспортировка в митохондрии
Эта стадия получила название трансэтирификации с карнитином. Перенос ацил-CoA в митихондриальных матрикс осуществляется через поры с участием карнитина и специальных ферментов — карнитин-ацилтрансфераз.
Для транспортировки через мембраны CoA заменяется на карнитин с образованием ацил-карнитина. Это вещество переносится в матрикс методом облегченной диффузии с участием ацил-карнитин/карнитинового переносчика.

Внутри митохондрий осуществляется реакция обратного характера, заключающаяся в отсоединении ретиналя, вновь поступающего в мембраны, и восстановлении ацил-CoA (в данном случае используется «местный» коэнзим А, а не тот, с которым была образована связь на стадии активации).
Электролиз , как окислительно-восстановительный процесс
Окислительно-восстановительные реакции могут происходить и при участии электрического тока. Например, если расплавить поваренную соль, то происходит расщепление кристаллической решетки на ионы: 2NaCl ⇄ Na+ + Cl- При этом образуются катион натрия и анион хлора. Если затем опустить в расплав электроды постоянного электрического тока, происходит следующее. Направляясь к катоду, катион натрия получает с него один электрон, т. е. происходит восстановление: Na+ + e—→Na
Следовательно, катод, на котором имеется постоянный избыток электронов, является восстановителем. К аноду направляется анион хлора. Поскольку на аноде постоянный недостаток электронов, атом хлора отдает электрон, т. е. окисляется: Сl— — е— → Сl Таким образом, а н о д, на котором постоянный недостаток электронов, является окислителем. Итак, всякий электролиз есть окислительно-восстановительный процесс, протекающий под действием электрического тока. (Запишите) В связи с тем что при электролизе в реакции принимает участие электрический ток, окислительно-восстановительный процесс приобретает ряд особенностей. Например, при электролизе водных растворов солей в процессе принимает участие вода. Так, электролиз раствора поваренной соли протекает по несколько иной схеме, нежели электролиз расплава. В растворе, помимо диссоциации, соли, протекает весьма слабо диссоциация воды: Н2O ⇄ Н+ + OH— Таким образом, в растворе образуется два вида катионов (Na+ и Н+) и два вида анионов (Сl— и ОН—). В ряду напряжений металлов натрий стоит намного левее водорода. Следовательно, он активнее, а значит, и легче отдает электроны. Если же речь идет (как в данном случае) о принятии электронов на катоде, то ион натрия, наоборот, будет труднее принимать электроны, чем ион водорода, и, следовательно, на катоде будет восстанавливаться не металлический натрий, а водород: Н+ + е— → Н (0) Ионы же натрия будут находиться в растворе до тех пор, пока полностью не разрядятся ионы водорода. К аноду направятся анионы Сl— и ОН—. Эти анионы также неодинаковы. Анион Сl— легче отдает свой электрон, чем анион ОН-, поэтому на аноде будет окисляться хлор, превращаясь в нейтральные атомы хлора: Сl— — е— → Сl В большинстве случаев анионы, состоящие из атомов одного элемента, такие, как Сl—, Вr—, I—, S2- и т. п., окисляются на аноде быстрее, чем гидроксильная группа.
Таким образом, при электролизе раствора поваренной соли на электродах получаются водород и хлор, а в растворе остаются ионы Na+ и ОН—. Эти ионы представляют собой в диссоциированном виде едкий натр NaOH.
■ 142. Почему при электролизе расплава NaCl можно получить металлический натрий, а при электролизе раствора NaCl era получить нельзя? 143. Чем объяснить, что в растворе при электролизе NaCl образуется щелочь NaOH? 144. Как осуществляется электролиз раствора KI? 145. В чем отличие процесса электролиза раствора СuСl2 от электролиза раствор а NaCl? (См. Ответ)
Способ наращивания металла на поверхности изделия электролитическим путем позволяет снимать точнейшие слепки и копии. Этот способ называется гальванопластикой.
Статья на тему Окислительно восстановительные реакции
Классификация
Выделяют четыре вида ОВР:
-
межмолекулярные – атомы окислителя и восстановителя находятся в молекулах разных веществ:
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O; -
внутримолекулярные – атомы окислителя и восстановителя входят в состав одного и того же вещества:
2KClO3 = 2KCl + 3O2; -
диспропорционирования или самоокисления-самовосстановления – атом одного и того же элемента выполняет функцию и восстановителя, и окислителя:
4K2SO3 = 3K2SO4 + K2S (в K2SO4 сера – восстановитель, в K2S – окислитель); -
контрпропорционирования – атомы одного элемента в составе исходных веществ имеют разные степени окисления, а конечных – одинаковую:
S+4O2 + 2H2S+2 = 3S + 2H2O.
Процесс окисления (отдачи электронов) записывают со знаком минус, показывая, сколько электронов получил окислитель: S-2 – 2ē → S, Al – 3ē → Al+3, Fe+2 – ē → Fe+3. Процесс восстановления (присоединения электронов) записывается со знаком плюса: Mn+4 + 2ē → Mn+2, S + 2ē → S-2, Cr+6 + 3ē → Cr+3.
Что мы узнали?
Из урока 9 класса химии узнали, что окислительно-восстановительная реакция – взаимодействие веществ с изменением степени окисления. Эта условная величина указывает, сколько электронов принял (со знаком минус) или отдал (со знаком плюс) атом. В результате взаимодействия акцепторов (окислителей) и доноров (восстановителей) возникает ковалентная связь. Различают четыре типа ОВР: межмолекулярные, внутримолекулярные, диспропорционирования, контрпропорционирования.
Тест по теме
-
Вопрос 1 из 5
Что такое акцептор?
- Окислитель, отдающий электроны
- Восстановитель, принимающий электроны
- Окислитель, принимающий электроны
- Восстановитель, отдающий электроны
Начать тест(новая вкладка)
Основные сведения о жирных кислотах
Жирные кислоты представляют собой углеродные цепи различной длины (от 4 до 36 атомов), которых по химической природе относят к карбоновым кислотам. Эти цепи могут быть как разветвленными, так и не разветвленными и содержать разное количество двойных связей. Если последние полностью отсутствуют, жирные кислоты называют насыщенными (характерно для многих липидов животного происхождения), а в противном случае — ненасыщенными. По расположению двойных связей жирные кислоты подразделяют на мононенасыщенные и полиненасыщенные.

Большинство цепей содержит четное число атомов углерода, что связано с особенностью их синтеза. Однако есть соединения с нечетным количеством звеньев. Окисление этих двух типов соединений несколько отличается.
Реакция над водой
Более двух млрд лет тому назад, растительные организмы совершили один из важнейших шагов на пути к началу эволюции. Начал формироваться процесс фотосинтеза. Однако изначально подвергались фотоокислению только восстановленные вещества сероводородного типа, что были представлены на земле в крайне малых размерах. Окисление воды – это процесс, привнесший в атмосферу значительное количество молекулярного кислорода. Это позволило перейти биоэнергетическим процессам на новый аэробный уровень. Это же явление позволило образоваться озоновому экрану, который защищает жизнь на Земле.






